Vậy Etilen C2H4 có những tính chất hoá học nào? có cấu tạo phân tử ra sao và được ứng dụng để làm những gì trong đời sống, chúng ta cùng tìm hiểu qua bài viết này.
Bạn đang đọc: Etilen C2H4 cấu tạo phân tử tính chất hoá học của etilen và bài tập – hoá 9 bài 37 – Trường THPT Thành Phố Sóc Trăng
• xem thêm:Một số dạng bài tập về Etilen và cách giải
I. Tính chất vật lý của Etilen C2H4
Bạn đang xem : Etilen C2H4 cấu tạo phân tử đặc thù hoá học của etilen và bài tập – hoá 9 bài 37
– Etilen là chất khí, không màu, không mùi, nhẹ hơn không khí và ít tan trong nước .
 II. Cấu tạo phân tử của Etilen C2H4
II. Cấu tạo phân tử của Etilen C2H4
– Trong phân tử etilen C2H4, có một link đôi giữa hai nguyên tử cacbon .
Công thức cấu tạo: 
– Trong link đôi có một link kém bền. Liên kêt này dễ đứt ra trong những phản ứng hóa học .
– Những hiđrocacbon mạch hở, trong phân tử có một link đôi như etilen gọi là anken, có công thức chung CnH2n với n ≥ 2 .
III. Tính chất hoá học của etilen C2H4
1) Etilen C2H4 Tác dụng với oxi:
– Khi đốt trong oxi, etilen cháy tạo thành khí CO2 và H2O, tỏa nhiều nhiệt .
C2H4 + 3O2 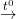 2CO2↑ + 2H2O
2CO2↑ + 2H2O
2) Etilen C2H4 tác dụng với dung dịch Brom
– Dung dịch Brom hay nước Brom có màu vàng da cam ; Ở phản ứng này, một link kém bền trong link dôi bị đứt ra và phân tử etilen phối hợp thêm một phân tử brom. Phản ứng trên gọi là. hàn ứng cộng .
CH2 = CH2 + Br2 ( dd ) → Br-CH2-CH2-Br
– Ngoài Brom, trong những điều kiện kèm theo thích hợp, etilen còn có phản ứng cộng vởi 1 số ít chất khác, như hiđro, …
3. Phản ứng trùng hợp của etilen C2H4
– Khi có xúc tác và nhiệt độ thích hợp, link kém bền trong phân tử etilen bị dứt ra làm cho những phân tử etilen tích hợp với nhau, tạo thành chất có phân tử lượng rất lớn gọi là polime .
…+ CH2=CH2 + CH2=CH2 + CH2=CH2 + … ![]() …- CH2– CH2– CH2– CH2– CH2– CH2-…
…- CH2– CH2– CH2– CH2– CH2– CH2-…
– Phản ứng trên được gọi là phản ứng trùng hợp, polietilen ( PE ) là chất rắn, không độc, không tan trong nước và là nguyên vật liệu quan trọng trong công nghiệp chất dẻo .
IV. Ứng dụng của Etilen C2H4
– Etilen dùng để sản xuất axit axetic, rượu etylic, poli ( vinyl clorua ), …
– Etilen dùng kích thích quả mau chín .
V. Bài tập về Etilen C2H4
Bài 1 trang 119 sgk hoá 9: Hãy tính số liên kết đơn, liên kết đôi giữa những nguyên tử cacbon trong phân tử các chất sau:
a ) CH3 – CH3 .
b ) CH2 = CH2 .
c ) CH2 = CH – CH = CH2 .
Lời giải bài 1 trang 119 sgk hoá 9:
a ) CH3 – CH3 có 1 link đơn C – C .
b ) CH2 = CH2 có 1 link đôi : C = C .
c ) CH2 = CH – CH = CH2 có 2 link đôi : C = C và 1 link đơn : C – C .
Bài 3 trang 119 sgk hoá 9: Hãy nêu phương pháp hóa học loại bỏ khí etilen có sẵn trong khí metan để thu được metan tinh khiết.
Lời giải bài 3 trang 119 sgk hoá 9:
– Dẫn hỗn hợp qua dung dịch brom dư, khi đó etilen phản ứng tạo thành đibrometan là chất lỏng ở lại trong dung dịch và chỉ có metan thoát ra .
CH2 = CH2 + Br2 → Br – CH2 – CH2 – Br .
Bài 4 trang 119 sgk hoá 9: Để đốt cháy 4,48 lít khí etilen cần phải dùng:
a ) Bao nhiêu lít oxi ?
b ) Bao nhiêu lít không khí chứa 20 % thể tích oxi ? Biết thể tích những khí đo ở điều kiện kèm theo tiêu chuẩn .
Lời giải bài 4 trang 119 sgk hoá 9:
a ) Phương trình phản ứng cháy etien :
C2H4 + 3O2 → 2CO2 + 2H2 O .
– Theo bài ra, ta có : nC2H4 = 4,48 / 22,4 = 0,2 ( mol ) .
– Theo PTPƯ : nO2 = 3. nC2H4 = 3.0,2 = 0,6 ( mol ) .
⇒ VO2 = n. 22,4 = 0,6. 22,4 = 13,44 ( lít ) .
b ) Thể tích không khí = 13,44. ( 100 / 20 ) = 67,2 lít .
Hy vọng với phần hệ thống lại kiến thức về tính chất hoá học của etilen và bài tập ở trên hữu ích cho các em, mọi thắc mắc các em hãy để lại bình luận dưới bài viết để được hỗ trợ, nếu bài viết hay hãy chia sẻ nhé các em. Chúc các em học tập tốt.
» Mục lục bài viết SGK Hóa 9 Lý thuyết và Bài tập
» Mục lục bài viết SGK Vật lý 9 Lý thuyết và Bài tập
Xem thêm: Top 16 clip pewpew chửi mới nhất 2022
Đăng bởi : trung học phổ thông Sóc Trăng
Chuyên mục : Giáo Dục
Source: https://taimienphi.club
Category: Chưa phân loại
