Trong bài viết hôm nay, GiaiNgo mang đến cho bạn đọc những kiến thức về các công thức hóa học lớp 10 đầy đủ, chi tiết nhất. Hy vọng đây sẽ là cuốn sổ tay công thức giúp bạn học tốt môn Hóa học lớp 10 nhé!
Các công thức hóa học lớp 10 đầy đủ, chi tiết nhất
Nội dung chương trình Hóa học lớp 10 có khá nhiều kỹ năng và kiến thức và công thức cần nhớ khiến bạn phải đau đầu. Vì thế, GiaiNgo sẽ giúp bạn tổng hợp các công thức hóa học lớp 10 trong từng chương một cách không thiếu, chi tiết cụ thể nhất .
Chương 1: Nguyên tử
Công thức tiên phong trong nội dung các công thức hóa học lớp 10 đó là công thức tính nguyên tử. Thành phần cấu trúc nguyên tử gồm hạt nhân ( số Proton + số Nơtron ) và vỏ nguyên tử ( Electron ) .
Ký hiệu nguyên tử
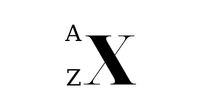
Trong đó :
- X là kí hiệu hóa học.
- A là số khối (số Proton + số Nơtron).
- Z là số hiệu nguyên tử.
Công thức tính
Số đơn vị chức năng điện tích hạt nhân :
- Z = số proton (P) = số electron (E)
- Z = P = E
Số khối của hạt nhân :
- A = Số proton (Z) + số nơtron (N)
- A = Z + N
Tổng các hạt trong nguyên tử = P. + E + N
Công thức tính nguyên tử khối trung bình :
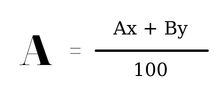
Trong đó :
- A, B lần lượt là nguyên tử khối của hai đồng vị A và B
- x, y lần lượt là tỉ lệ phần trăm số nguyên tử của mỗi đồng vị A và B.
Cách xác lập Tỷ Lệ các đồng vị :
- Gọi % của đồng vị 1 là x %
⇒ % của đồng vị 2 là ( 100 – x ) .
- Lập phương trình tính nguyên tử khối trung bình ⇒ giải được x.
Công thức tính thể tích nguyên tử :
V = 4/3πr³ (r là bán kính nguyên tử)
Khối lượng riêng của nguyên tử :
D = m/V
- 1 mol nguyên tử chứa N = 6,023 x 10 mũ 23 nguyên tử.
Chương 2: Bảng tuần hoàn các nguyên tố hóa học – Định luật tuần hoàn
Trước khi tìm hiểu và khám phá các công thức hóa học lớp 10 trong chương 2, tất cả chúng ta cùng mạng lưới hệ thống lại kiến thức và kỹ năng về vị trí nguyên tố trong bảng tuần hoàn nhé !
Vị trí nguyên tố trong bảng tuần hoàn
- Số thứ tự ô bằng số hiệu nguyên tử bằng số proton bằng số electron.
- Số thứ tự chu kì bằng số lớp electron.
- Số thứ tự nhóm bằng số electron hóa trị.
Các công thức tạo bởi nguyên tố R, thuộc nhóm nA trong bảng tuần hoàn
- Công thức oxit cao nhất:
- R2On
- Với n là số thứ tự của nhóm.
- Công thức hợp chất khí với hydro:
- RH8- n
- Với n là số thứ tự của nhóm.
Trong cùng chu kỳ luân hồi, khi điện tích hạt nhân tăng, hóa trị cao nhất với oxi tăng từ 1 đến 7, hóa trị so với hydro giảm từ 4 đến 1 .
Chương 3: Liên kết hóa học
Các công thức hóa học lớp 10 trong chương 3 – Liên kết hóa học gồm :
Hiệu độ âm điện và liên kết hóa học
Xét hợp chất có CTHH dạng AxBy
Hiệu độ âm điện :
ΔxA – B = |xA – xB|
Nếu :
- 0 ≤ ΔxA – B < 0,4: Liên kết cộng hóa trị không cực.
- 0,4 ≤ ΔxA – B < 1,7: Liên kết cộng hóa trị có cực.
- ΔxA – B ≥ 1,7: Liên kết ion.
Cách xác định số oxi hóa
- Quy tắc 1: Số oxi hóa của các nguyên tố trong các đơn chất bằng 0 (VD: H2, O2, N2,…).
- Quy tắc 2: Trong 1 phân tử, tổng số oxi hóa của các nguyên tố bằng 0.
- Quy tắc 3: Các ion đơn nguyên tử có số oxi hóa bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tố bằng điện tích của ion.
- Quy tắc 4: Trong hợp chất, số oxi hóa của Hydro bằng +1 (trừ trường hợp như hydrua, kim loại như NaH, CaH2,… có số oxi hóa bằng −1). Số oxi hóa của Oxy bằng −2 (trừ trường hợp F2O, peoxit như H2O2, Na2O2).
Chương 4: Phản ứng oxi hóa – khử
Phản ứng oxi hoá – khử là phản ứng hoá học mà ở đó đó có sự chuyển electron giữa các chất tham gia vào phản ứng. Hay nói cách khác, đây là phản ứng có sự đổi khác số oxi hoá của một số nguyên tố .
Vậy các công thức hóa học lớp 10 trong phản ứng oxi hóa – khử là gì, cùng GiaiNgo tò mò ngay nào .
Định luật bảo toàn electron
∑ne nhường = ∑ne nhận
Cân bằng phương trình phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron
- Bước 1: Xác định số oxi hóa và ghi số oxi hoá của những nguyên tố có số oxi hoá thay đổi.
- Bước 2: Viết phương trình phản ứng và cân bằng.
- Bước 3: Tìm hệ số thích hợp của chất oxi hóa và chất khử sao cho tổng số electron nhường bằng với tổng số electron nhận.
Chương 5: Nhóm halogen
Nhóm halogen thuộc nhóm VII A trong bảng tuần hoàn các nguyên tố hóa học. Nhóm halogen gồm các nguyên tố Clo ( Cl ), Flo ( F ), Brom ( Br ) và Iot ( I ) .
Công thức tính khối lượng muối thu được khi cho sắt kẽm kim loại phản ứng hết với HCl :
m muối = m KL + m gốc axit
Công thức tính khối lượng muối clorua thu được khi toàn tan hết hỗn hợp sắt kẽm kim loại bằng HCl giải phóng H2 :
m muối clorua = m hỗn hợp KL + 71.nH2
Chương 6: Oxi – Lưu huỳnh
Các công thức hóa học lớp 10 chương Oxi – Lưu huỳnh gồm :
- Khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp kim loại bằng H2SO4 loãng giải phóng H2:
m muối sunfat = m hỗn hợp KL + 96.nH2
- Khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp oxit kim loại bằng H2SO4 loãng:
m muối sunfat = m hỗn hợp KL + 80.nH2SO4
- Khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp các kim loại bằng H2SO4 đặc, nóng giải phóng khí SO2:
m muối = m hỗn hợp KL + 96.nSO2
- Khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp các kim loại bằng H2SO4 đặc, nóng giải phóng khí SO2, S, H2S:
m muối = m hỗn hợp KL + 96.(nSO2 + 3nS + 4nH2S)
Chương 7: Tốc độ phản ứng – Cân bằng hóa học
Tốc độ phản ứng
Tốc độ phản ứng là sự đổi khác ( độ biến thiên ) nồng độ của chất phản ứng hoặc loại sản phẩm trong một đơn vị chức năng thời hạn .
Xét một phản ứng có sự tham gia của chất A từ thời gian t1 đến t2 .
Tốc độ phản ứng của A là:
Δv = – ΔC/Δt
Trong đó :
- ΔC: Độ biến thiên nồng độ của chất (lấy trị tuyệt đối)
- Δt: Khoảng thời gian xảy ra sự biến thiên nồng độ.
Nếu vận tốc phản ứng tính theo loại sản phẩm B thì :
v = ΔC/Δt
Do đó, công thức tổng quát tính vận tốc phản ứng trong khoảng chừng thời hạn từ t1 đến t2 :
v = ± ΔC/Δt
Biểu thức tốc độ phản ứng :
v = k.[A]a.[B]b
Trong đó :
- k: Hằng số tỉ lệ (hằng số vận tốc).
- [A], [B]: Nồng độ mol chất A, B
Độ biến thiên nồng độ ( ΔC ) của các chất trong phản ứng hoàn toàn có thể khác nhau. Tốc độ phản ứng của từng chất hoàn toàn có thể khác nhau .
Cân bằng hóa học
Xét phản ứng thuận nghịch : aA + bB ↔ cC + dD, ta có :
- Phản ứng thuận: A + B → C + D.
- Phản ứng nghịch: C + D → A + B.
Phản ứng ở trạng thái cân đối :
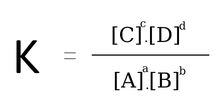
Lưu ý : Đối với phản ứng có chất rắn thì không viết nồng độ chất rắn vào biểu thức tính K .
Như vậy, GiaiNgo đã giúp bạn củng cố các công thức hóa học lớp 10. Ngoài việc nắm vững các kiến thức và kỹ năng về mặt triết lý thì việc rèn luyện các bài tập vận dụng là điều thiết yếu. Cùng GiaiNgo giải 1 số ít bài tập vận dụng ngay nào .

Bài tập vận dụng các công thức hóa học lớp 10
Bài 1: Tổng số hạt cơ bản của 1 nguyên tử X là 82, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 22. Xác định X.
Hướng dẫn giải:
Ta có : P. + N + E = 82
⇒ 2P + N = 82 ( 1 ) ( Vì P = E )
Mà tổng số hạt mang điện nhiều hơn số hạt không mang điện là 22, nên
2P – N = 22 ( 2 )
Từ ( 1 ) và ( 2 ) ⇒ P = E = 26, N = 30
⇒ A = P. + N = 56
Vậy X là Fe
Bài 2 Khi đun nóng 11,07g KMnO4 ta được 10,11g bã rắn A và chất khí B. Tính thể tích B ở (đktc) được giải phóng?
Hướng dẫn giải:
PTHH : KMnO4 → K2MnO4 + MnO2 + O2
Áp dụng định luật bảo toàn khối lượng :
mB = 11,07 – 10,11 = 0,96 ( g ) = mO2
nO2 = m / M = 0,96 / 32 = 0,03 ( mol )
VO2 = n x 22,4 = 0,03 x 22,4 = 0,672 ( lít )
Bài 3: Hòa tan hoàn toàn 19,2 gam Cu bằng dung dịch HNO3 thu được V lít khí NO ở đktc (NO là sản phẩm khử duy nhất). Tìm giá trị của V.
Hướng dẫn giải:
nCu = 19,2 / 64 = 0,3 ( mol )
Ta có :
Cu ( 0 ) → Cu ( + 2 ) + 2 e
N ( + 5 ) + 3 e → N ( + 2 )
Cứ 1 mol Cu sẽ nhường 2 e, do đó 0,3 mol Cu sẽ nhường 0,3 x 2 = 0,6 mol
Giải sử số mol NO cần tìm là X thì số e để tạo ra X mol NO là 3X
Áp dụng định luật bảo toàn electron :
∑ ne nhường = ∑ ne nhận ⇔ 0,6 = 3X ⇒ X = 0,2
⇒ V = 0,2 x 22,4 = 4,48 ( lít )
Bài 4: Hòa tan hết 11,1 gam hỗn hợp 3 kim loại trong dung dịch H2SO4 loãng dư thu được dung dịch A và 8,96 lít khí ở đktc. Cô cạn dung dịch A được m gam muối khan. Tính m?
Hướng dẫn giải:
Theo đề ta có :
nH2 = V / 22,4 = 8,96 / 22,4 = 0,4 ( mol )
Áp dụng công thức : m muối = mKL + 96. nH2 = 11,1 + 96.0,4 = 11,1 + 38,4 = 49,5 ( g )

Trên đây là tổng thể các công thức hóa học lớp 10 mà GiaiNgo san sẻ với bạn. Hy vọng các công thức hóa học lớp 10 sẽ là bước đệm giúp bạn tiếp thu kiến thức và kỹ năng mới trong lớp 11 tốt hơn. Chúc các bạn học tốt và đừng quên theo dõi GiaiNgo mỗi ngày nhé !
Source: https://taimienphi.club
Category: Chưa phân loại